2023年4月25日,欧盟委员会授权一项以转基因菌株为原料的新型食品投放市场。此前,欧盟新型食品目录中的2'—岩藻糖基乳糖由转基因大肠杆菌菌株发酵产生,本次批准将转基因谷氨酸棒杆菌菌株产生的2'—岩藻糖基乳糖作为新型食品,自2023年5月16日起正式生效。
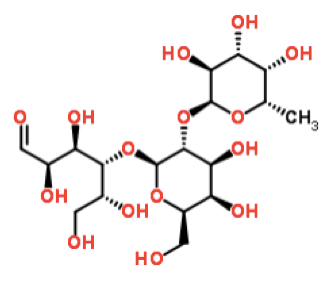
2'-岩藻糖基乳糖英文名称2′-fucosyllactose,简称2'-FL,分子量为488.44,CAS号是41263-94-9,化学式为C18H32O15,生产方式包括化学法、酶法和微生物发酵法。2'-FL是人类母乳中含量最丰富的一种低聚糖,约占30%,同时存在于猪、牛等动物乳汁中。2'-FL是由乳糖与L-岩藻糖组成的非还原性三糖,其还原性末端连接一个乳糖,非还原端的岩藻糖通过α-1,2-键与乳糖结构中的半乳糖连接,分子结构如下图所示:
2'-岩藻糖基乳糖在国外以转基因菌株为原料批准使用情况:
根据欧洲委员会法规(EU)2017/2470, 2’-岩藻糖基乳糖已被批准作为新食品原料(Novel Food),包括合成法来源、转基因大肠杆菌BL21菌株生产来源和转基因大肠杆菌K-12菌株生产来源。
澳大利亚新西兰食品标准局(FSANZ)发布通告,批准使用2’-FL(微生物发酵生产)或与LNnT(微生物发酵生产)在婴儿配方食品和幼儿配方补充食品中的应用。此后FSANZ对通过转基因大肠杆菌菌株发酵生产的2’-FL用于婴儿配方食品、较大婴儿配方食品和幼儿配方补充食品的应用申请发布批准报告。
我国在2016年就有企业开始申报以微生物来源的2’-岩藻糖基乳糖,申报类型为营养强化剂,申报使用范围为婴幼儿配方食品。但一直未有进展。2021年下半年,卫健委受理了3款2’-岩藻糖基乳糖作为食品添加剂新品种的申报事项,此三款产品目前均已经在补正资料中。其中合成法来源的产品虽已于2021年10月发布了征求意见稿,但后续再次延期发补,目前仍处于资料补正阶段,就在近日(2023年7月14日)卫健委又发布一款2’-岩藻糖基乳糖受理公告。
2'-岩藻糖基乳糖以转基因微生物来源申报新食品添加剂新品种在我国获批展望
我国是从2021年正式打开转基因微生物食品添加剂的申报路径,在过去,国家卫健委仅受理转基因微生物酶制剂的新品种申报,其他由转基因微生物生产的新食品原料或食品添加剂新品种均无法申报,这或许便是2016年申报的那款2'-岩藻糖基乳糖迟迟未有进展的原因。从当前法规背景下用转基因微生物发酵的2'-岩藻糖基乳糖在身边路径上畅通的,另外,获得美国FAD GRAS认证的2'-FL产品中,绝大多数为转基因微生物来源,包括转基因大肠杆菌和转基因谷氨酸棒杆菌。而欧盟同样批准了转基因微生物来源的2'-FL。从国家政策到外部环境分析用转基因微生物发酵的2'-岩藻糖基乳糖批准食品添加剂新品种只是时间问题了。
申报这类食品添加剂时,申请人需要按照要求分别提交如下两套资料:
转基因微生物来源申报新食品添加剂新品种申请部门及流程:
相较于其他食品添加剂新品种,转基因微生物食品添加剂的申报更为复杂,需要经过两个监管部门的评估或审批。
1、农业农村部:负责转基因微生物的安全性评估;
基因微生物的安全性评估材料提交国家卫健委,由卫健委转递给农村农业部对转基因微生物的安全性评估,农村农业部将评估后将意见发至卫健委,卫健委再对食品添加剂新品种进行审评审批。
